近日,食品与生物工程学院张红印教授团队在顶级期刊《尖端科学》(Advanced Science)在线发表论文Identification and application of a novel patulin degrading enzyme from Meyerozyma guilliermondii。博士生张钰为第一作者,张红印教授、杨其亚副教授为共同通讯作者,课题组赵倩华、Solairaj、Esa、张乐和白雪参与该项工作。

展青霉素(Patulin,PAT)是一种剧毒的真菌次级代谢产物,主要由扩展青霉分泌产生,可污染苹果、梨果、葡萄等水果及其制品。PAT对动物及人体的危害主要表现为致癌性、免疫毒性、生殖毒性、皮肤毒性、肠毒性、肝毒性及肾毒性。传统控制PAT污染的物理和化学方法均存在一定的缺陷与不足,而生物法因其安全和高效性受到广泛关注。生物法主要通过微生物及其产生的酶脱除PAT,而酶促脱毒技术可避免微生物的二次污染,更具工业化应用前景。然而,目前文献中报道的PAT生物降解酶的种类、数量及性能均有限,亟需筛选和鉴定新型高效的PAT降解酶,解析其酶学性质和催化机制,从而开发性能优异的固定化酶,以期推动工业化生产与应用。
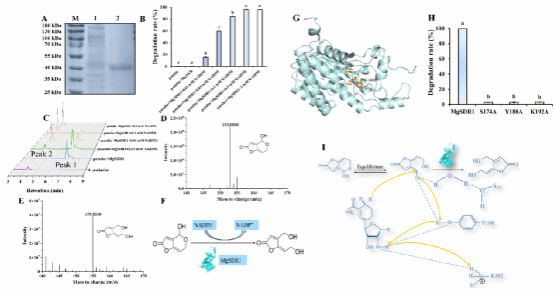
该研究联合RNA-seq及分子对接技术分析了Meyerozyma guilliermondii降解PAT的分子机制,发现M. guilliermondii通过增强抗氧化胁迫、GSH代谢、DNA损伤修复、DNA复制、生长和繁殖、抗性和耐药、潜在降解酶的解毒以及锌指转录因子的调控相关基因的表达来解除或降低PAT胁迫造成的有害影响。该研究还筛选到了一个新型PAT降解酶(短链脱氢酶/还原酶(short-chain dehydrogenase/reductase,MgSDR1))。MgSDR1可在2 h内将10 μg/mL初始浓度的PAT转化为无毒的E-ascladiol。进一步研究发现,生物降解过程对新鲜梨汁的品质没有负面影响。此外,结合分子对接及氨基酸定点突变技术分析了催化三联体(Ser174、Tyr188和Lys192)对MgSDR1降解PAT能力的影响,将上述三个氨基酸残基突变为丙氨酸后,突变蛋白几乎不能降解PAT,表明MgSDR1的催化三联体在PAT降解过程中发挥重要作用。
该研究得到国家自然科学基金项目(32172641;32272383)和江苏省研究生科研创新项目(KYCX23_3632)的资助。(食品与生物工程学院)
文章链接:https://doi.org/10.1002/advs.202501146